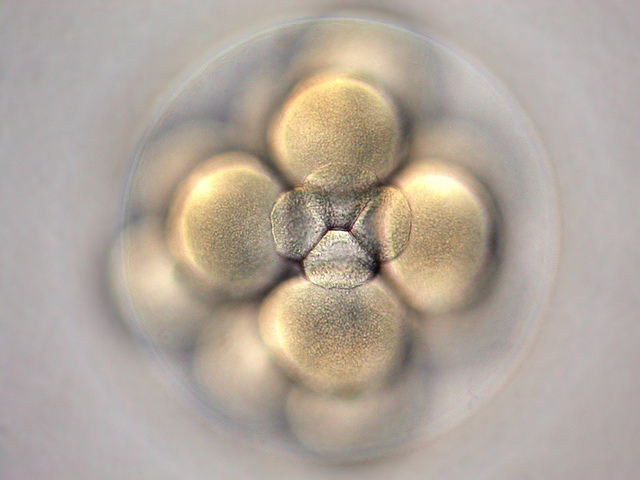
Gastrulation, mécanotransduction, phosphorylation et autres facteurs de transcription : bienvenue dans le monde fabuleux de la biologie moléculaire du développement ! L’équipe d’Emmanuel Farge navigue au milieu de ces notions pour décrypter les événements qui régissent les premières étapes de la vie du poisson zèbre (Danio rerio) et de la mouche du vinaigre (Drosophilia), au sein de l’équipe “Mécanique et génétique du développement embryonnaire et tumoral” de l’Institut Curie (Paris). Comme son nom l’indique, ce groupe de biologistes français s’intéresse en particulier aux liens qu’entretiennent la mécanique et la génétique, deux domaines qui de prime abord n’ont pourtant que peu de points communs.
Le “dogme central” de la biologie, établi en 1958 par Francis Crick (l’un des “inventeurs” de la structure moléculaire de l’ADN), stipule que la vie cellulaire est déterminée par le génome, stocké sur la molécule d’ADN sous forme de séquences d’acides aminés appelées gènes, lesquelles aboutissent à la synthèse de protéines, molécules assurant le métabolisme cellulaire. Mais si toutes les cellules d’un organisme partagent le même patrimoine génétique, elles se comportent de façon différente grâce à un ensemble de protéines spécifiques. La question des variations du métabolisme entre les différents types cellulaires se pose avec une acuité particulière au moment du développement de l’embryon, lorsque l’organisme passe d’une cellule à deux, puis quatre, puis huit… au départ toutes identiques, puis spécialisées (on dit différenciées) afin de donner naissance aux cellules sanguines, aux neurones ou encore aux cellules épithéliales. D’où surgit ce “programme” de différenciation ? Est-il purement gouverné par la génétique, comme le laisseraient entendre les tenants du “tout génétique” enivrés par la beauté conceptuelle du dogme central ? Des physiciens ont commencé à émettre une hypothèse concurrente : les forces physiques qui s’appliquent aux cellules en division seraient responsables de leur organisation, et partant de là de leur différenciation et de la formation des différents organes. C’est notamment la thèse de Vincent Fleury, un physicien français qui insiste sur le rôle majeur des “écoulements” de cellules en division dans l’embryon dans l’apparition du plan d’ensemble de l’organisme. Pour Emmanuel Farge et ses collègues, la réponse se situe entre ces deux extrêmes : si les gènes contrôlent la genèse des tissus à partir des cellules embryonnaires en division, les mouvements de ces dernières et les forces mécaniques qu’elles exercent les unes sur les autres à cette occasion modifieraient également l’expression des gènes !
Le contrôle physique de l’expression des gènes, une vieille histoire

Les biologistes français se sont penchés sur la phase de gastrulation, qui débute vers la quatorzième division cellulaire : l’embryon, qui comporte alors plusieurs dizaines de milliers de cellules, commence à s’organiser en différents “feuillets”, préludes à une architecture plus complexe de l’organisme. Au cours d’une étape particulière du développement – appelée épibolie chez le poisson et invagination chez la mouche – certaines cellules se trouvent dilatées (appartenant à des feuillets en extension), ce qui se traduit au niveau moléculaire par le déplacement d’une protéine, la β-caténine, vers le noyau. Cette translocation est permise par ce que les biologistes appellent une phosphorylation, c’est-à-dire une modification de la structure chimique de la protéine qui modifie ses propriétés biologiques. Enfin, l’arrivée de la β-caténine dans le noyau agit comme un facteur de transcription en venant modifier l’expression de gènes impliqués dans le développement.
Cette cascade d’événements trouve bien son origine dans un phénomène mécanique : elle est reproduite à l’identique lorsque les biologistes exercent une contrainte mécanique externe (par l’intermédiaire d’un aimant déplaçant des cellules rendues magnétiques, comme nous l’avions évoqué dans un précédent article) sur les cellules embryonnaires. Ainsi, une pression mécanique, une notion appartenant au monde de la physique, se traduit dans la cellule par la phosphorylation d’une protéine, c’est-à-dire une réaction chimique, qui assure son introduction dans le noyau où elle va interagir avec l’ADN et réguler l’expression d’un gène, un phénomène au cœur du dogme central de la biologie. Cette traduction biologique d’un stimulus physique est appelée mécanotransduction.
La réelle nouveauté de ces recherches réside dans la similitude du mécanisme de mécanotransduction chez la mouche et le poisson zèbre, deux espèces pourtant distantes d’un point de vue évolutif. En effet, si ces deux espèces respectent un plan d’organisation symétrique, les classant parmi les bilatériens, la mouche appartient aux protostomiens quand le poisson est un deutérostomien (cette distinction étant établie selon l’évolution embryonnaire des feuillets donnant les futurs bouches et anus). Pour Emmanuel Farge et ses collègues, ce rôle commun de la protéine β-caténine en réponse à une contrainte mécanique chez les mouches et les poissons zèbres remonterait ainsi à 570 millions d’années, période estimée où vivait l’urbilatérien, le dernier ancêtre commun des bilatériens. Si elle est connue depuis peu, l’influence de la physique sur le physique des organismes vivants n’est donc pas une nouveauté !
Source : T. Brunet et al., Evolutionary conservation of early mesoderm specification by mechanotransduction in Bilateria, Nature Communications, 27 novembre 2013.
Crédit photo : Bruno C. Vellutini – Flickr (CC BY-SA 2.0) ; André Karwath – Wikimedia Commons (CC BY-SA 2.5) / Pogrebnoj-Alexandroff – Wikimedia Commons (CC BY-SA 3.0).