Le graphène est un peu le DSK des matériaux : il multiplie les unes et les gros titres depuis sa découverte en 2004, et déchaîne les passions, ou plutôt les inventions, des chimistes et des physiciens de par le monde. Il n’est pourtant constitué que d’un seul élément, qui n’a rien d’exotique : le carbone. Des atomes de carbone arrangés de façon régulière, sur un seul plan, de façon à former un cristal bi-dimensionnel, l’équivalent d’une couche, épaisse d’un seul atome, du graphite de nos mines de crayon. Cette structure particulière lui confère des propriétés éblouissantes : une résistance à la rupture 200 fois supérieure à celle de l’acier tout en étant 6 fois plus léger, une conduction de la chaleur et du courant électrique excellente, en faisant le matériau idéal pour les transistors de nos ordinateurs… Une équipe de chimistes menée par Charudatta Galande de l’université Rice à Houston (États-Unis), s’est penchée sur ses qualités optiques, et a cherché à rendre le graphène… fluorescent.
Tout d’abord, précisons ce que les chimistes entendent par fluorescence. Une molécule peut être “excitée” lorsqu’elle est éclairée par une lumière dite incidente : celle-ci lui cède alors de l’énergie, la lumière se définissant en effet de façon équivalente par l’énergie de ses photons ou par sa longueur d’onde (c’est la fameuse dualité onde-corpuscule de la lumière, mise en évidence par Albert Einstein puis Louis de Broglie). Une fois placée dans cet état haut en énergie, instable, la molécule va se désexciter et revenir à son état normal, en éjectant le trop-plein d’énergie sous forme de photon. C’est cette lumière émise par la molécule lors de sa désexcitation que l’on nomme fluorescence : un matériau produit donc de la lumière à partir de lumière. La lumière d’émission ayant une longueur d’onde différente de la lumière d’excitation, elle apparaît d’une autre couleur (les longueurs d’onde du domaine visible sont comprises entre 400 nanomètres pour le violet et 800 nanomètres pour le rouge). Cette fluorescence est très utilisée en biologie, notamment pour l’imagerie des différents constituants de la cellule par microscopie confocale. D’où l’intérêt pour les chimistes de développer de nouveaux fluorophores (des molécules capables d’émettre de la fluorescence).
Rendre le carbone fluo
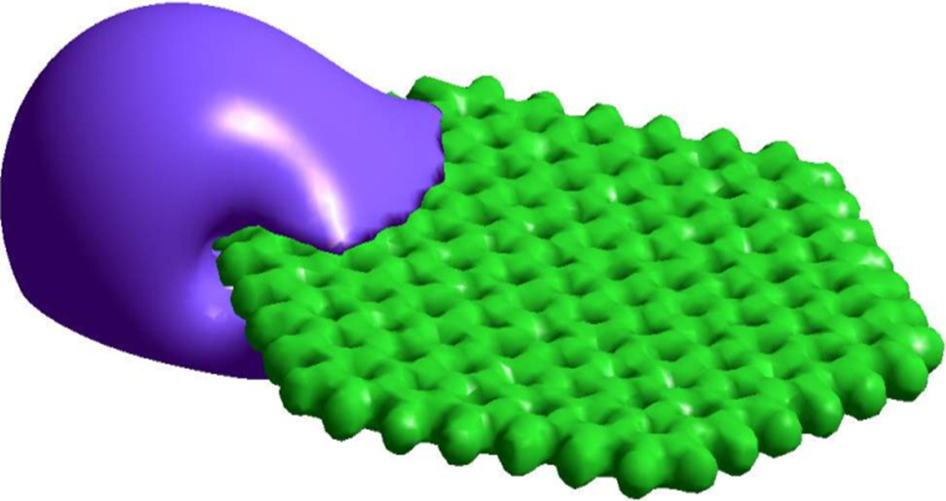
Revenons au graphène. Pour obtenir de ce matériau des propriétés optiques intéressantes, il existe deux alternatives : soit le tailler en très petit (il adopte alors des comportements quantiques particuliers liés à sa faible taille, comme pour les quantum dots, ou boîtes quantiques en langue vernaculaire), soit le fonctionnaliser, c’est-à-dire lui adjoindre des groupes chimiques spécifiques pour lui conférer de nouvelles fonctions. C’est cette seconde voie qu’ont emprunté les chimistes américains, en formant des oxydes de graphène. Ainsi modifié, le graphène peut être porté dans un état excité, puis émettre en retour une fluorescence lors de sa désexcitation. Les oxydes de graphène sont fonctionnalisés par des groupes tels les carboxyles COOH, qui ont un comportement différent en milieu acide ou basique. Les propriétés de fluorescence du matériau vont varier avec l’acidité de son environnement : la fluorescence émise peut être modulée, passant du rouge (λ = 683 nm) en milieu acide au bleu-vert (λ = 479 et 506 nm) en milieu basique.
L’étude souligne une autre caractéristique intéressante de ce graphène fluorescent. Des calculs quantiques indiquent que la perturbation des charges électroniques, liée à l’état excité, est limitée aux atomes de carbone voisins du groupe oxydé, le reste du cristal de graphène n’étant pas affecté par cette perturbation. Le graphène se comporte ainsi comme un feuillet contenant un nombre limité de fluorophores “quasi-moléculaires” car confinés autour des groupements oxydés. Quel intérêt ? les caractéristiques optiques de ce type de fluorophores sont bien définies, notamment leurs longueurs d’onde d’excitation et d’émission qui sont déterminées de façon précise. Ces caractéristiques du graphène offrent un contrôle plus précis pour l’expérimentateur dans le choix des faisceaux laser qu’il utilise pour provoquer la fluorescence et des couleurs qu’il souhaite observer.
Source : C. Galande et al., Quasi-Molecular Fluorescence from Graphene Oxide, Scientific Reports, 8 septembre 2011.
Crédits photo : Lothar Schermelleh (CC BY-SA 3.0).